近日,我校生命科學(xué)學(xué)院、亞熱帶農(nóng)業(yè)生物資源保護(hù)與利用國(guó)家重點(diǎn)實(shí)驗(yàn)室和嶺南現(xiàn)代農(nóng)業(yè)科學(xué)與技術(shù)廣東省實(shí)驗(yàn)室劉耀光院士/祝欽瀧研究員團(tuán)隊(duì)在國(guó)際知名學(xué)術(shù)期刊Plant Biotechnology Journal(IF2021=13.263,生物學(xué)/工程技術(shù)1區(qū))在線發(fā)表了題為“Efficient assembly of long DNA fragments and multiple genes with improved nickase-based cloning and Cre/loxP recombination”的研究論文(論文鏈接:https://onlinelibrary.wiley.com/doi/10.1111/pbi.13882),利用特異核苷酸序列引導(dǎo)的缺刻酶介導(dǎo)的DNA組裝與Cre/loxP重組相結(jié)合,開(kāi)發(fā)了一種新的簡(jiǎn)單、高效、低成本的大片段DNA克隆與多基因疊加系統(tǒng)TGSII-UNiE。

功能基因組學(xué)、合成生物學(xué)、分子農(nóng)場(chǎng)的應(yīng)用、復(fù)雜性狀的遺傳改良以及代謝工程操作等,都涉及到DNA大片段(LDNA)的克隆和多基因的組裝。盡管目前已有多種DNA組裝技術(shù),如Golden Gate克隆、重組酶系統(tǒng)、Gibson組裝等,但仍然存在操作復(fù)雜、耗時(shí)費(fèi)力且價(jià)格昂貴的問(wèn)題。因此,開(kāi)發(fā)一種簡(jiǎn)單、高效、低成本的DNA組裝方法十分必要。缺刻酶(Nicking endonuclease,NiE)是一類能在DNA單鏈特定識(shí)別序列產(chǎn)生缺刻的限制性內(nèi)切酶。當(dāng)其被設(shè)計(jì)到DNA片段末端時(shí),經(jīng)過(guò)酶切和變性時(shí),就能產(chǎn)生單鏈突出末端,已被用于缺刻酶介導(dǎo)的不依賴連接酶克隆(NiE-mediated ligation-independent cloning,NiE-LIC)。NiE-LIC具有操作簡(jiǎn)單和成本低的優(yōu)點(diǎn),但是由于其創(chuàng)制的單鏈突出末端較短(小于10個(gè)堿基(nt)),多片段組裝效率低。為此,該研究通過(guò)序列優(yōu)化設(shè)計(jì)得到了一系列15 nt的特異核苷酸序列(Unique nucleotide sequences,UNSs),并使用熱穩(wěn)定的Taq DNA 連接酶和采用變溫連接(thermo-cycle ligation),開(kāi)發(fā)了更高效的特異核苷酸序列引導(dǎo)的缺刻酶介導(dǎo)的DNA組裝(UNS-guided NiE-mediated DNA assembly,UNiEDA)。進(jìn)一步將UNiEDA引入到作者之前開(kāi)發(fā)的Cre/loxP介導(dǎo)的多基因疊加系統(tǒng)TGSII(TransGene Stacking II)中,開(kāi)發(fā)了一種新的簡(jiǎn)單、高效、低成本的大片段DNA克隆與多基因疊加系統(tǒng)TGSII-UNiE(圖1)。
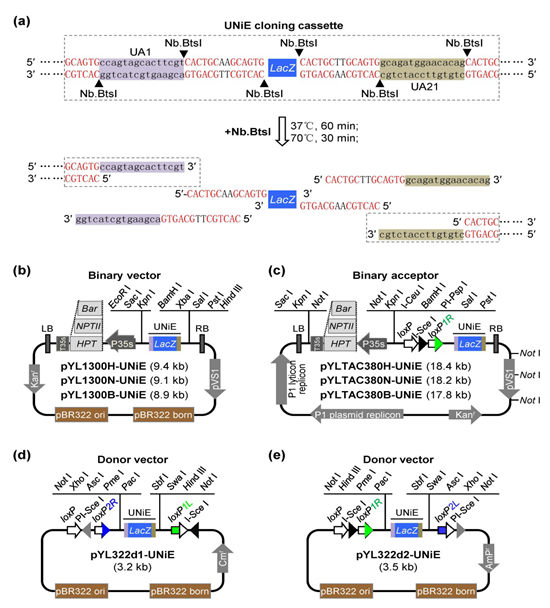
圖1 TGSII載體系統(tǒng).(a)UNiE克隆盒的序列特征;(b)含UNiE克隆盒的pCAMBIA骨架的雙元載體;(c)含UNiE克隆盒的TAC骨架的雙元接受載體;(d和e)含UNiE克隆盒的多基因供給載體
對(duì)不同長(zhǎng)度的DNA大片段(10.3 kb、14.8 kb和22.9 kb)的克隆測(cè)試結(jié)果表明,UNiEDA能高效的克隆不同長(zhǎng)度的DNA大片段,且其克隆效率與采用試劑盒的Gibson組裝方法相似,價(jià)格更低。載體與DNA大片段的摩爾比為1:3時(shí),UNiEDA的效率最高;對(duì)于相同的DNA大片段,雙元接受載體pYLTAC380H-UNiE的克隆效率高于pYL1300H-UNiE。對(duì)4個(gè)2.5 kb左右的DNA片段組裝效率測(cè)試也表明,UNiEDA與Gibson組裝方法具有相似的多DNA片段組裝效率,且更經(jīng)濟(jì)。進(jìn)一步,選用便于觀察的紅色甜菜紅素與綠色熒光作為易檢測(cè)的可視化marker,用UNiEDA直接在雙元接受載體(pYL1300H-UNiE和pYLTAC380H-UNiE)上成功組裝了含5個(gè)基因(均采用P35s啟動(dòng)子與Tnos終止子表達(dá)盒)的多基因載體(包括合成甜菜紅素的四個(gè)基因BvCYP76AD1S, BvDODA1S, cDOPA5GT 和 ADH與一個(gè)綠色熒光蛋白基因eGFP)pYL1300H-CDGAeG和pYLTAC380H-CDGAeG,利用農(nóng)桿菌介導(dǎo)的遺傳轉(zhuǎn)化,在本氏煙草葉片瞬時(shí)表達(dá),以及穩(wěn)定的轉(zhuǎn)基因水稻愈傷與植株中,均能觀察到甜菜紅素的合成與綠色熒光,證明了UNiEDA能有效的組裝含重復(fù)序列的多個(gè)DNA片段,構(gòu)建的多基因載體是有功能的(圖2)。對(duì)于少數(shù)基因(1-5個(gè),或總長(zhǎng)在12-15 kb以內(nèi))的組裝,不需要重組反應(yīng),可直接利用UNiEDA在雙元載體或雙元接受載體上完成多基因組裝。此外,利用上述結(jié)構(gòu),該研究探討了相同啟動(dòng)子重復(fù)使用的問(wèn)題,發(fā)現(xiàn)當(dāng)重復(fù)使用P35S啟動(dòng)子超過(guò)5次時(shí)(結(jié)構(gòu)pYL1300H-CDGeG和pYL1300H-CDGAeG),甜菜紅素在多數(shù)轉(zhuǎn)基因水稻愈傷組織和植株中不能正常合成,表明可能發(fā)生了同源啟動(dòng)子引起的轉(zhuǎn)基因表達(dá)沉默,以及同源重組刪除導(dǎo)致的轉(zhuǎn)基因結(jié)構(gòu)的不穩(wěn)定性。因此相同啟動(dòng)子重復(fù)使用時(shí),建議最多不超過(guò)4次。
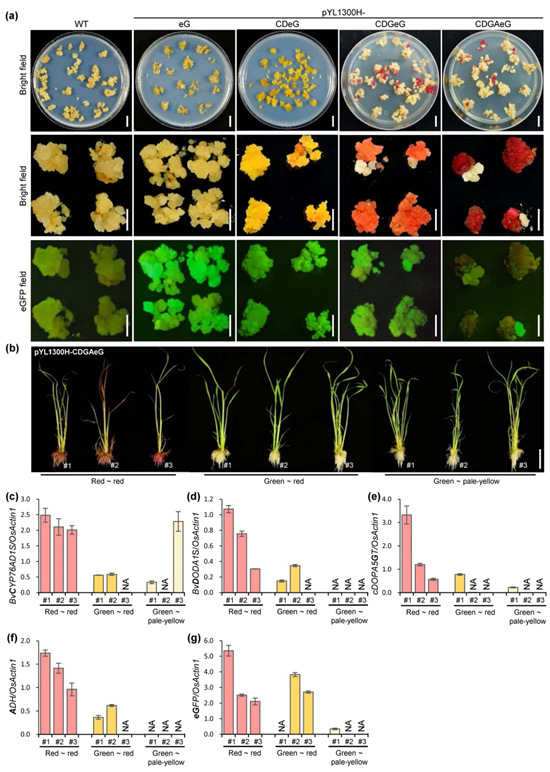
圖2 甜菜紅素在轉(zhuǎn)基因水稻中的合成。(a)四個(gè)多基因載體(pYL1300H-eG, pYL1300H-CDeG, pYL1300H-CDGeG and pYL1300H-CDGAeG)獲得的轉(zhuǎn)基因水稻愈傷表型;(b)pYL1300H-CDGAeG獲得轉(zhuǎn)基因水稻植株表型:Red ~ red表示從紅色愈傷組織分化獲得的紅色轉(zhuǎn)化植株;Green ~ red表示從紅色愈傷組織分化獲得的綠色轉(zhuǎn)化植株(無(wú)甜菜紅素合成);Green ~ pale-yellow表示從淡黃色愈傷組織分化獲得的綠色植株(無(wú)甜菜紅素合成);(c-g)轉(zhuǎn)基因水稻植株外源基因的qRT-PCR分析
為測(cè)試更多基因的組裝能力,該研究在合成甜菜紅素的基礎(chǔ)上,進(jìn)一步在多基因供給載體上分別組裝了與抗病相關(guān)的單子葉植物特有的脂肪族酚胺-羥基肉桂酰腐胺(HP)基因簇的3個(gè)基因(OsODC, OsPHT3 和OsPHT4),以及與氮代謝利用相關(guān)的3個(gè)谷氨酰胺合成酶基因(OsGS1;1, OsGS1;2 和 OsGS1;3),通過(guò)2輪簡(jiǎn)單的Cre/loxP重組,構(gòu)建完成了含有12個(gè)基因(包括HPT篩選標(biāo)記基因)T-DNA區(qū)約40 kb的多基因雙元載體pYLTAC380H-GSs/HPs/CDGAeG(圖3)。上述結(jié)果表明,在組裝更多基因時(shí),TGSII-UNiE系統(tǒng)更具有優(yōu)勢(shì):利用UNiEDA在雙元接受載體與多基因供給載體上,可同時(shí)平行進(jìn)行多基因組裝,最后只需1-2輪的Cre/loxP重組,就能完成更多基因與合成途徑的組裝。
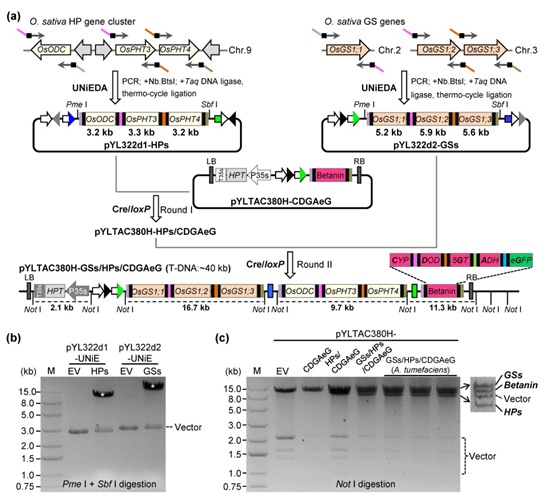
圖3 TGSII-UNiE系統(tǒng)對(duì)多基因的高效組裝。(a)利用UNiEDA方法分別在多基因供給載體上一步組裝HP基因簇的3個(gè)基因(OsODC, OsPHT3 和OsPHT4)與谷氨酰胺合成酶的3個(gè)基因(OsGS1;1, OsGS1;2 和 OsGS1;3),再通過(guò)兩輪簡(jiǎn)單的Cre/loxP重組,組裝上述多個(gè)基因到含5個(gè)基因的雙元接受載體,獲得含12個(gè)基因的多基因雙元載體pYLTAC380H-GSs/HPs/CDGAeG;(b)多基因供給載體的酶切檢測(cè);(c)多基因雙元載體的酶切檢測(cè)與在農(nóng)桿菌中的穩(wěn)定性檢測(cè)
綜上, 該研究開(kāi)發(fā)的TGSII-UNiE 系統(tǒng),具有設(shè)計(jì)簡(jiǎn)單、操作方便、高效、省時(shí)、成本低等優(yōu)點(diǎn),可有效克隆長(zhǎng) DNA 片段并快速組裝多個(gè)基因,在合成生物學(xué)與代謝工程等研究領(lǐng)域顯示出巨大的應(yīng)用前景。劉耀光院士團(tuán)隊(duì)祝欽瀧研究員課題組長(zhǎng)期致力于植物合成生物學(xué)、基因編輯和基因工程共性技術(shù)的開(kāi)發(fā)與應(yīng)用研究,已在Plant Biotechnology Journal發(fā)表了多研究論文,如開(kāi)發(fā)了高效廣靶向植物腺嘌呤堿基編輯系統(tǒng)PhieABEs(DOI: 10.1111/pbi.13774)、高效的模塊化熒光融合蛋白工具箱AioFFP(DOI: 10.1111/pbi.13790)和高效的多基因疊加新系統(tǒng)TGSII-UNiE(DOI: 10.1111/pbi.13882),為植物功能基因組學(xué)、合成生物學(xué)、代謝工程和作物遺傳改良等方面的研究提供能了實(shí)用工具與強(qiáng)有力的技術(shù)支撐。
生命科學(xué)學(xué)院博士生趙延昌,博士后韓靖鸞和譚健韜,碩士生楊雅茜為論文的共同第一作者,祝欽瀧研究員與劉耀光院士為論文的共同通訊作者。該研究得到了嶺南現(xiàn)代農(nóng)業(yè)科學(xué)與技術(shù)廣東省實(shí)驗(yàn)室項(xiàng)目、廣東省基礎(chǔ)與應(yīng)用基礎(chǔ)研究重大項(xiàng)目、國(guó)家自然科學(xué)基金和廣東特支計(jì)劃科技創(chuàng)新青年拔尖人才專項(xiàng)的資助。
文圖/生命科學(xué)學(xué)院



